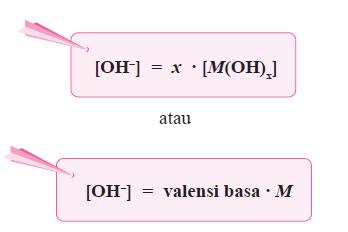
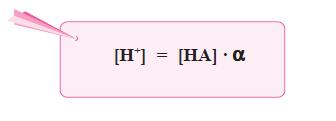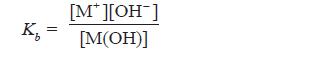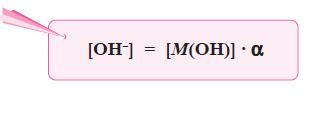Sediaan steril adalah sedian yang selain memenuhi persyaratan
fisika-kimia juga persyaratan steril. Steril berarti bebas
mikroba. Sterilisasi adalah proses untuk mendapatkan kondisi steril. Desinfektan adalah pembunuh baktreri yang penggunannya pada benda
mati, misalnya pada lantai. Antiseptik adalah pembunuh bakteri yang
penggunannya pada jaringan hidup, misalnya pada kulit dan luka.
Injeksi adalah sediaan steril yang diberikan melalui penyuntikkan
pada lapisan kulit. Infus adalah sediaan yang penggunannya sama dengan
injeksi teapi volumenya lebih besar (lebih dari 100 ml). Radiofarmasi
yaitu sediaan farmasi yang obat aktifnya merupakan zat
radioaktif. Larutan irigasi adalah larutan steril yang dipakai secara
topikal, untuk mencuci sela-sela atau lubang tubuh termasuk luka
(merupakan larutan NaCl 0,9%, dikemas dalam volume besar dan botol mulut
lebar). Zat diagnostik adalah zat-zat yang digunakan untuk mendiagnosis. Misal evans blue
untuk kontrol volume darah. Ekstrak alergenik adalah zat yang digunakan
untuk menguji sensitivitas terhadap sesuatu, misal antibiotik. Ekstrak
ini diencerkan dengan aqua steril saat akan digunakan.
Sediaan steril dapat berwujud:
1. Padat steril
- Merupakan obat steril
- Merupakan obat untuk injeksi, yaitu obat kering yang
disuspensikan bila akan digunakan. Contoh: sodium ampisilin. Karena
ampisilin tidak stabil dalam cairan, maka dibuat padat. Cara
pembuatannya yaitu dengaa liofilisasi pada suhu rendah dengan
pengeringan steril, kemudian didinginkan sampai -60oC untuk
pembekuan. Selanutnya dilakukan sublimasi (dengan pengurangan tekanan
secara bertahap), cairan menguap, sodium ampisilin padat tertinggal.
2. Semi padat, misal salep mata.
3. Cair, misal injeksi.
Syarat obat dikatakan berkualitas jika memenuhi syarat sebagai berikut:
- Efikasi
Efikasi mencakup kemanjuran suatu obat yang dalam terapi termasuk efektivitas obat dalam terapi.
2.
Safety
Keamanan ini antara lain meliputi: keamanan dosis obat dalam terapi,
memberikan efek terapi sesuai dengan yang diinginkan dan tidak
memberikan efek toksik atau efek samping yang tidak diinginkan.
3.
Aceeptable
Maksudnya disukai oleh pasien. Jadi obat perlu dibuat sedemikian menarik dan mudah dipakai konsumen.
Faktor-faktor yang mempengaruhi kualitas sediaan:
1. Terapi, meliputi:
- Dosis efektif obat. Obat dibuat dalam dosiss yang disesuaikan dengan dosis terapi efektif obat tersebut.
- Lama penggunaan obat. Hal ni juga berpengaruh pada
penentuan bentuk sediaan obat yang akan dibuat dan besarnya dosis obat,
sehingga pasien tetap merasa nyaman selama terapi.
- Farmakokinetika obat. Meliputi waktu paruh, absorpsi, t ½ eliminasi, Vd, Cl, dan lain-lain.
2. Sifat fisika-kimia meliputi:
- Ukuran partikel
- Sifat alir
- Kompaktibilitas
- Ketahanan terhadap kelembapan
Sifat fisika kimia inilah yang menetukan formulasi dan pemilihan metode pembuatan sediaan obat.
* Sediaan Parental
Keuntungan sediaan parenteral:
- Aksi obat lebih cepat
- Cocok untuk obat inaktif jika diberikan oral
- Obat yang mengiritasi bila diberikan secara oral
- Kondisi pasien (pingsan, dehidrasi) sehingga tidak memungkinkan obat diberikan secara oral.
Kerugian sediaan parenteral:
- Tidak praktis
- Butuh alat khusus (untuk injeksi)
- Sakit
- Risiko, kalau alergi atau salah obat maka tidak bisa langsung dihilangkan
- Butuh personil khusus, misal di rumah sakit oleh dokter atau perawat.
Alasan obat dibuat sediaan parenteral:
1. Kadar obat sampai ke target
Jumlah obat yang sampai ke jaringan target sesuai dengan jumlah yang diinginkan untuk terapi.
2. Parameter farmakologi
Meliputi waktu paruh, C maks., onset.
3. Jaminan dosis dan kepatuhan
Terutama untuk pasien-pasien rawat jalan
4. Efek biologis
Efek biologis tidak dapat dicapai karena obat tidak bisa dipakai
secara oral. Contoh: amphoterin B (absorbsi jelek) dan insulin (rusak
oleh asam lambung).
5. Altrnatif rute, jika tidak bisa lewat oral.
6. Dikehendaki efek lokal dengan menghindari efek atau reaksi toksik sistemik.
Contoh: methotreksat, penggunaan secara intratekal untuk pengobatan leukimia.
7. Kondisi pasien
Untuk pasien-pasien yang tidak sadar, tidak kooperatif, atau tidak bisa dikontrol
8.
Inbalance (cairan badan dan elektrolit)
Contoh: muntahber serius, sehingga kekurangan elektrolit yang penting dan segera harus dikembalikan
9. Efek lokal yang diinginkan. Contoh: anestesi lokal
Faktor-faktor farmasetik yang berpengaruh pada penggunaan parenteral:
- Kelarutan obat dan volume injeksi
Kelarutan obat akan berpengaruh pada volume injeksi, jika mudah larut
mak volume yang diberikan kecil. Untuk obat yang sukar larut dapat
dibuat dalam bentuk suspensi atau dengan kosolvensi.
2. Karakteristik bahan pembawa
- W
ater: air ada spesifikasi khusus
- W
ater-miscible solvent (solven yang campur dengan air)
- W
ater-immiscible solvent (solven yang tidak campur dengan air)
3. pH dan osmolalitas injeksi
a. Isohidris yaitu pH larutan sama dengan pH darah.
Kalau bisa pH sama dengan pH darah, tapi tidak selalu, tergantung pada
stabilitas obat. Contoh: injeksi aminofilin dibuat sangat basa karena
pada kondisi asam akan terurai. Dalam pembuatan ditambahkan etilendiamin
untuk menaikkan kelarutan dari aminofilin.
Aminofilin injeksi 2,4% 24%
R/ Teofilin 2,0 20,0
Etilen diamin 0,55 5,5
Aqua p.i. ad 100 ad 100 ml
Cara pemberian i.v. i.m.
b. Isotonis, yaitu tekanan osmosis larutan sama
dengan tekanan osmosis cairan tubuh. Di luar isotonis disebut paratonis,
meliputi: hipotonis dan hipertonis.
- Hipotonis yaitu tekanan osmosis larutan lebih kecil dari tekanan
osmosis cairan tubuh (NaCl 0,9%). NaCl jika terurai menjadi Na (15,1
mOsmol) dan Cl (154 mOsmol) sehingga total 308 mOsmol. Sedangkan tekanan
osmosis cairan tubuh yaitu 300 mOsmol. Pada hipotonis, cairan masuk ke
tubuh dan masuk ke sel darah merah, sehingga sel darah merah bisa pecah
(irreversibel)
- Hipertonis, yaitu tekanan osmosis larutan lebih besar dari tekanan
osmosis cairan tubuh. Air kan mengalir keluar dari sel darah sehinggga
sel mengkerut (krenasi), bersifat reversibel.
4. Tipe bentuk sediaan
- Larutan
- Suspensi
- Emulsi
- Solid
Kecepatan pelepasan obat dari bentuk sediaan:
- A
quous solution
- A
quous suspensi
- O
leagonous solution
- O
il in water (o/w)
- W
ater in oil (w/o)
- O
leagenous
Mekanisme pelepasan:
- Suspensi: berlaku sebagai obat yang hipertonis, mengambil cairan
dari jaringan sekitar. Maka, akhirnya bisa larut. Walau sudah larut
semua, cairan tetap sebagai hipertonis.
- Oleagenous:
o/w –> iv
w/o –> tidak boleh i.v.
Mengapa w/o lebih lama? Karena water keluar dulu dari sistem emulsi, baru masuk k sel tubuh. Jadi ada dua barier.Suspensi: terlarut, statusnya tetap hipertonis.
Cara menghitung isotonis:
1. Cara w
Satuan g% atau g/100 ml
Contoh:
Dibuat 100 ml, kadar 10 mg/ml.
a = 0.101
b = 0.76
Jawab:
Kadar metadon = 10mg/ml = 1000 mg/100ml = 1 g/100ml (1%).
NaCl 0.9% = 0.52 (disebut isotonis)
1/0.9 x 0.52 = 0.76 (isotonis)
Zat itu hipo atau hiper?
Lihat a. Jika
a = 0.52 (isotonis)
a < 0.52 (hipotonis)
a > 052 (hipertonis)
w = zat pengisotonis yang perlu ditambahkan
kalau tanda negatif ditulis, hipernya berapa?
2. Cara h
H = mh / fh x (0.28 fa/ma x a + fb/mb x b …….) g/L
mh = berat
fh = faktor disosiasi
- Netral : 1
- Asam lemah, baa lemah : 1.5
- Kuat : 1.8
Contoh infus laktat:
NaCl 0.3 (a) –> 3 g/L
KCl 0.1 (b) –> 1 g/L
CaCl2 0.1 (c) –> 1 g/L
Aqua ad 100 –> 1000
Jawab:
h = 1.8/58.5 x 3 + 1.8/….. x 1 + 1.8/…… x 1
Dalam penggunaan metode h lebih simpel, tidak perlu tabel
SYARAT SEDIAAN STERIL
Harus memenuhi 3 syarat berikut, yaitu secara fisika, kimia, dan biologi.
* FISIKA
Tipe sediaan larutan
- Sediaan obat harus jernih. Jernih maksudnya tidak ada partikel yang
tidak larut dalam sediaan tersebut. Jadi, meskipun sediaan berwarna,
tetap terlihat jernih (tidak keruh).
- Tidak berwarna. Maksudnya sediaan larutan bisa saja berwarna, namun
warna larutan sama dengan warna zat aktifnya sehingga tidak ada campuran
warna lain dalam sediaan itu.
- Bebasa dari partikel asing. Partikel asing; partikel yang bukan
penyusun obat. Sumber partikel bisa berasal dari: air, bahan kimia,
personil yang bekerja, serat dari alat/pakaian personil, alat-alat,
lingkungan, pengemas (gelas, plastik).
- Keseragaman volume/berat. Terutama untuk sediaan solid steril.
- Memenuhi uji kebocoran. Terutama untuk injeksi yang dikemas dalam ampul. Uji kebocoran dapat dilakukan dengan:
- Uji dengan larutan warna (
dye bath test)
- Metode penarikan vakum ganda (
the double vacuum pull method)
6. Stabil.
Artinya sediaan tidak mengalami degradasi fisika.
Misal jika bentuk sediaan larutan maka sediaan tersebut tetap berada
dalam bentuk larutan (bukan suspensi). Sifat stabil ini berkaitan dengan
formulasi. Ketidakstabilan dapat dilihat dari:
a. Terjadi perubahan warna
Contoh: larutan adrenalin yang awalnya berwarna jernih karena teroksidasi akan menjadi merah karena terbentuk adenokrom.
b.Terjadi pengendapan
Contoh: injeksi aminophilin dibuat dengan air bebas CO
2, karena jika tidak bebas CO
2 maka akan terbentuk theopilin yang kelarutannya kecil dalam air sehingga akan mengendap. Akibatnya dosis menjadi berkurang.
CO
2 + H
2O –> H
2CO
3 (asam)
Aminopilin + Asam –> theopilin + etilen diamin
Pengatasan: injeksi aminophilin dibuat dari theopilin dan etilen diamin berlebih.
Tipe sediaan SUPENSI
MACAM PELARUT
1. Air
Air merupakan pelarut utama. Akan dijelaskan lebih mendetail setelah ini.
2. Pelarut yang dapat campur dengan air (
water miscible solvent).
Jika zat aktif dari sediaan injeksi tidak stabil dalam air, maka
pengatasannya dengan dibentuk sediaan kering steril atau dengan sistem
kosolvensi. Aqua kosolven: pelarut pembantu, tidak pernah dipakai
tunggal, tetapi campuran. Macam-macam kosolven yang bisa digunakan:
- glikols (glikol, propilen glikol, PEG BM rendah). PEG bersifat
higroskopis sehingga kemampuan untuk melarutkan zat kurang, sehingga
dipakai yang anhidrous dan BM rendah. Propilen glikol + benzil akohol
(suhu 40oC), untuk injeksi digoxin.
- etanol/alkohol
- dimetil asetamid, dimetil formasmide, DMSO. Pelarut ini larut
sempurna dengan air, toksisitas akutnya rendah, toksisitas kronisnya
merusak liver.
- N-(B-hidroksietil), laktamid
- aseton (kosolven pada obat antitumor dan antibiotik)
- asam organik (asam laktat, asam sitrat)
- surfaktan (emulphor EL-714, chremophor, plurnic F 68, lesitin)
- antibeku (gliserol sp 5%, alkohol 15%).
3. Pelarut yang tidak dapat campur dengan air (
water immiscible solvent).
Contoh: minyak kacang (
peanut oil), minyak wijen (
oleum sesame), minyak biji kapas (
cotton seed), minyak jagung (
corn oil), minyak zaitun (olive), paraben cair.
Oleum sesame
dianggap pelarut yang paling baik untuk jenis pelarut golongan ini
karena mengandung komponen penstabil (pencegah tengik). Sedangkan
paraben sekarang dilarang penggunaanya.
Sebagai pelarut juga harus emenuhi batasan klorida, kalsium, ion sulfat, CO
2. logam berat,
oxidizable substance dengan total zat padat terlarut kurang dari 10 ppm (ppm = % x 10
4).
REVERSE OSMOSIS
Reverse Osmosis yaitu metode pemurnian air dengan prinsip pemisahan
solute melalui membran semipermiabel dari konsentrasi tinggi ke
kosentrasi rendah. Maka akan terjadi penolakan terhadap solut pada
permukaan filter sehingga tidak bisa menembus membran. RO merupakan
kebalikan dari osmosis. Osmosis adalah dari konsentrasi rendah ke
tinggi. Filter dipasang untuk menyaring partikel kasar. Berdasarkan ukuran partikel, filter dibuat berbeda ukuran porinya.
Partikel besar
↓
Bakteri
↓
Virus
↓
Pirogen
↓
Ion
Untuk membunuh nikroba dapatdengan klorinasi/penambahan kaporit.
Namun kaporit ini tidak boleh ada dalam air, jadi harus dihilangkan
dengan karbon aktif. Selanjutnya karbon aktif dapat dipisahkan dari air
dengan filter.
Keuntungan RO:
1. Energi lebih efisien dibanding dengan destilasi
2. Hasil labih banyak
3. Biaya lebih murah
Kerugian RO:
1.
In process control lebih ketat
2. Air segera digunakan pada waktu 24 jam, jikalebih dari itu maka
harus disimpan pad suhu
70-80oC agar kualitas air tidak menurun.
Manfaat:
1. Air minum dari air laut
2. pembuatan WFI
Cara penyimpanan air untuk injeksi:
WFI disimpan dalam suhu ekstrim untuk mencegah pertumbuhan mikroba yaitu suhu < 5oC atau 80oC. Sumber panas dapat dipakai steam atau hot water. Heat exchanger berfungsi untuk menurunkan suhu pada storage tank sebelum digunakan. Jika suhu masih terlalu tinggi maka akan masuk ke return sirkuit.
Air yang dihasilkan harus dicek dalam endotoksinometer dan dijaga kadar
endotoksin < 0,25 SU/ml, ion klor, ammonia, partikel padat.
METODE STERILISASI
Sumber pencemaran produk:
1.
Manusia
2. Bahan awal
Untuk masuk ruangan steril harus dibungkus rangkap tiga:
- Lapisan 1 (terluar): dilepas sebelum masuk ruangan penyangga
- Lapisan 2: dilepas diruang penyangga
- Lapisan 3: masuk ruangan steril
3. Produk sendiri (pencemaran sendiri). Untuk kontrol kebersihan, kotoran maksimal 10 ppm.
4. Air di pabrik
5. Udara atau lingkungan pabrik
6. Makanan dan minuman
7. Sisa bahan pembersih
8. Limbah pabrik (harus diproses dengan baik)
9. Instalasi pembuangan
10. Serangga dan hewan lain (pengerat), atau hewan percobaan.
Macam limbah: cair, padat, cair semipadat, suara dalam desibel, gas.
Limbah lain dapat diproses dulu seperti beta-laktam, sepalosporin baru
boleh dicampur bahan lain. Di gudang dipasang alat penangkap serangga
dan tikus. Bila suatu mesin akan digunkan untuk proses suatu zat,mak mesin harus
dibilas dulu dan bilasan terakhir tidak boleh mengandung lebih dari 10
ppm zat sebelumnya.
Pengecekan limbah:
a. Fisika: diaduk, pengenapan, dilihat kejernihan
b. Kimia. Parameter: Biologycal Oxygen Demand (BOD0, Chemical Oxygen Deand (COD, dan Dissolve Oxygen (DO).
c. Biologi: dengan ikan mas, jika tidak ada yang mati berate kotoran
inimal. Mengap ikan mas? Karena ikan mas sensitif terhadap air kotor.
Uji sterilitas
Ada beberapa metode:
1. Direct inoculation of culture medium
Meliputi pengujian langsung dari sampel dalam media pertumbuhan. Menurut British Farmakope:
a. media tioglikolat cair yang mengandung glukosa dan Na Tioglikolat cocok untuk pembiakan aerob. Suhu inkubasi 30-35
oC.
b. Soya bean casein digest medium
Media ini membantu pertumbuhan bakteri anaerob dan fungsi. Suhu inkubasi 30-35
oC, sedang fungi 20-25
oC.
2. Membran filtrasi
Teknik yang banyak direkomendasikan farmakope, meliputi filtrasi
cairan melalui membran steril. Filter lalu ditanam dalam media. Masa
inkubasi 7-14 hari karena mungkin organisme perlu adaptasi dulu.
3. Introduction od concentrate culture medium
Medium yang pekat langsung dimasukkan dalam wadah sampel yang akan
ditumbuhkan. Tidak banyak digunakan, hanya dipakai bila ada kecurigaan
akan adanya bakteri.
Uji pirogen
1. Secara kualitatif: Rabbit test
Berdasarkan respon demam pada kelinci. Digunakan kelinci karena
kelinci menunjukkan respon terhadap pirogen sesuai dengan keadaan
manusia. Kenaikan suhu diukur melalui rektal.
2. Secara kuantitatif: LAL test
Cara uji in vitro dengan menggunakan sifat membentuk gel dari lisat
amebasit dari limulus polifemus. Uji ini 5-10 kali lebih sensitif dari
Rabbit test.
Kondisi LAL-test:
a. pH larutan 6-7
b. suhu 37
oC
c. kontrol negatif: aquadest (pelarut)
d. kontrol positif (pirogen/endotoksin)
e. keuntungan: cepat, mudah, praktis
Semoga bermanfaat hhe... :)
Kunjungi Juga:
http://www.poltekkestasikmalaya.ac.id