Alhamdulillah walaupun baru berdiri kita sudah punya alat instrument yaitu HPLC, apa sih HPLC?, bagian-bagiannya apa saja, dan fungsinya untuk apa? mari simak penjelasan sebagai berikut....
HPLC (High Performance Liquid Chromatography) atau
biasa juga disebut dengan Kromatografi cair kinerja tinggi (KCKT) dikembangkan
pada akhir tahun 1960-an dan awal tahun 1970-an. Saat ini, HPLC merupakan
teknik pemisahan yang diterima secara luas untuk analisis bahan obat, baik
dalam bulk atau dalam sediaan farmasetik.
SISTEM PERALATAN HPLC
Instrumentasi HPLC pada dasarnya terdiri atas:
wadah fase gerak, pompa, alat untuk memasukkan sampel (tempat injeksi), kolom,
detektor, wadah penampung buangan fase gerak, dan suatu komputer atau
integrator atau perekam.
Diagram skematik sistem kromatografi cair seperti ini :
Diagram skematik sistem kromatografi cair seperti ini :

1. Wadah Fase gerak dan Fase gerak
Wadah
fase gerak harus bersih dan lembam (inert). Wadah pelarut kosong ataupun labu
laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini biasanya dapat
menampung fase gerak antara 1 sampai 2 liter pelarut(1).
Fase
gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat bercampur
yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya elusi dan
resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase
diam, dan sifat komponen-komponen sampel. Untuk fase normal (fase diam lebih
polar daripada fase gerak), kemampuan elusi meningkat dengan meningkatnya
polaritas pelarut. Sementara untuk fase terbalik (fase diam kurang polar
daripada fase gerak), kemampuan elusi menurun dengan meningkatnya polaritas
pelarut. Fase
gerak sebelum digunakan harus disaring terlebih dahulu untuk menghindari
partikel-partikel kecil ini. Selain itu, adanya gas dalam fase gerak
juga harus dihilangkan, sebab adanya gas akan berkumpul dengan komponen
lain terutama di pompa dan detektor sehingga akan mengacaukan analisis.
Elusi
dapat dilakukan dengan cara isokratik (komposisi fase gerak tetap selama elusi)
atau dengan cara bergradien (komposisi fase gerak berubah-ubah selama elusi)
yang analog dengan pemrograman suhu pada kromatografi gas. Elusi bergradien
digunakan untuk meningkatkan resolusi campuran yang kompleks terutama jika
sampel mempunyai kisaran polaritas yang luas.4) Fase
gerak yang paling sering digunakan untuk pemisahan dengan fase terbalik adalah
campuran larutan bufer dengan metanol atau campuran air dengan asetonitril.
Untuk pemisahan dengan fase normal, fase gerak yang paling sering digunakan adalah
campuran pelarut-pelarut hidrokarbon dengan pelarut yang terklorisasi atau
menggunakan pelarut-pelarut jenis alkohol. Pemisahan dengan fase normal ini
kurang umum dibanding dengan fase terbalik.
2. Pompa
Pompa
yang cocok digunakan untuk HPLC adalah pompa yang mempunyai syarat
sebagaimana syarat wadah pelarut yakni: pompa harus inert terhadap fase gerak.
Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, Teflon, dan
batu nilam. Pompa yang digunakan sebaiknya mampu memberikan tekanan sampai 5000
psi dan mampu mengalirkan fase gerak dengan kecepatan alir 3 mL/menit. Untuk
tujuan preparatif, pompa yang digunakan harus mampu mengalirkan fase gerak
dengan kecepatan 20 mL/menit.
Tujuan penggunaan pompa atau sistem penghantaran fase gerak adalah untuk menjamin proses penghantaran fase gerak berlangsung secara tepat, reprodusibel, konstan, dan bebas dari gangguan. Ada 2 jenis pompa dalam HPLC yaitu: pompa dengan tekanan konstan, dan pompa dengan aliran fase gerak yang konstan. Tipe pompa dengan aliran fase gerak yang konstan sejauh ini lebih umum dibandingkan dengan tipe pompa dengan tekanan konstan.6)
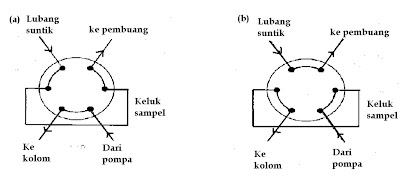
Sampel-sampel
cair dan larutan disuntikkan secara langsung ke dalam fase gerak yang mengalir
di bawah tekanan menuju kolom menggunakan alat penyuntik yang terbuat dari
tembaga tahan karat dan katup teflon yang dilengkapi dengan keluk sampel
(sample loop) internal atau eksternal.
Posisi pada saat memuat sampel Posisi pada saat menyuntik sampel
4. Kolom dan Fase diam
Ada 2 jenis
kolom pada HPLC yaitu kolom konvensional dan kolom mikrobor. Kolom
merupakan bagian HPLC yang mana terdapat fase diam untuk berlangsungnya
proses pemisahan solut/analit. Kolom mikrobor mempunyai 3 keuntungan yang utama
dibanding dengan kolom konvensional, yakni:
- Konsumsi fase gerak kolom mikrobor hanya 80% atau lebih kecil dibanding dengan kolom konvensional karena pada kolom mikrobor kecepatan alir fase gerak lebih lambat (10 -100 μl/menit).
- Adanya aliran fase gerak yang lebih lambat membuat kolom mikrobor lebih ideal jika digabung dengan spektrometer massa.
- Sensitivitas kolom mikrobor ditingkatkan karena solut lebih pekat, karenanya jenis kolom ini sangat bermanfaat jika jumlah sampel terbatas misal sampel klinis.
Meskipun
demikian, dalam prakteknya, kolom mikrobor ini tidak setahan kolom konvensional
dan kurang bermanfaat untuk analisis rutin.3] Kebanyakan fase diam
pada HPLC berupa silika yang dimodifikasi secara kimiawi, silika yang
tidak dimodifikasi, atau polimer-polimer stiren dan divinil benzen. Permukaan
silika adalah polar dan sedikit asam karena adanya residu gugus silanol
(Si-OH). Silika dapat dimodifikasi secara kimiawi dengan menggunakan
reagen-reagen seperti klorosilan. Reagen-reagen ini akan bereaksi dengan gugus
silanol dan menggantinya dengan gugus-gugus fungsional yang lain.
Oktadesil silika (ODS atau C18) merupakan fase diam yang paling banyak digunakan karena mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang, maupun tinggi. Oktil atau rantai alkil yang lebih pendek lagi lebih sesuai untuk solut yang polar. Silika-silika aminopropil dan sianopropil (nitril) lebih cocok sebagai pengganti silika yang tidak dimodifikasi. Silika yang tidak dimodifikasi akan memberikan waktu retensi yang bervariasi disebabkan karena adanya kandungan air yang digunakan.
Oktadesil silika (ODS atau C18) merupakan fase diam yang paling banyak digunakan karena mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang, maupun tinggi. Oktil atau rantai alkil yang lebih pendek lagi lebih sesuai untuk solut yang polar. Silika-silika aminopropil dan sianopropil (nitril) lebih cocok sebagai pengganti silika yang tidak dimodifikasi. Silika yang tidak dimodifikasi akan memberikan waktu retensi yang bervariasi disebabkan karena adanya kandungan air yang digunakan.
5. Detektor HPLC
Detektor pada HPLC dikelompokkan menjadi 2
golongan yaitu: detektor universal (yang mampu mendeteksi zat secara umum,
tidak bersifat spesifik, dan tidak bersifat selektif) seperti detektor indeks
bias dan detektor spektrometri massa; dan golongan detektor yang spesifik yang
hanya akan mendeteksi analit secara spesifik dan selektif, seperti detektor
UV-Vis, detektor fluoresensi, dan elektrokimia.
Idealnya, suatu detektor harus mempunyai karakteristik sebagai berikut:
Idealnya, suatu detektor harus mempunyai karakteristik sebagai berikut:
- Mempunyai respon terhadap solut yang cepat dan reprodusibel.
- Mempunyai sensitifitas yang tinggi, yakni mampu mendeteksi solut pada kadar yang sangat kecil.
- Stabil dalam pengopersiannya.
- Mempunyai sel volume yang kecil sehingga mampu meminimalkan pelebaran pita.
- Signal yang dihasilkan berbanding lurus dengan konsentrasi solut pada kisaran yang luas (kisaran dinamis linier).
- Tidak peka terhadap perubahan suhu dan kecepatan alir fase gerak.2)
Beberapa detektor yang paling sering digunakan pada HPLC dengan
karakteristik detektor seperti berikut :
Detektor
|
Sensitifitas
(g/ml)
|
Kisaran
linier
|
Karakteristik
|
Absorbansi Uv-vis
Fotometer filter
Spektrofotometer
spektrometer photo-diode
array
|
5 x 10-10
5 x 10-10
> 2 x
10-10
|
104
105
105
|
Sensitivitas bagus,
paling sering digunakan, selektif terhadap gugus-gugus dan struktur-struktur
yang tidak jenuh.
|
Fluoresensi
|
10-12
|
104
|
Sensitifitas sangat
bagus, selektif, Tidak peka terhadap perubahan suhu dan kecepatan alir fase
gerak.
|
Indeks bias
|
5 x 10-7
|
104
|
Hampir bersifat
universal akan tetapi sensitivitasnya sedang. Sangat sensitif terhadap suhu,
dan tidak dapat digunakan pada elusi bergradien
|
Elektrokimia
Konduktimetri
Amperometri
|
10-8
10-12
|
104
105
|
Peka terhadap
perubahan suhu dan kecepatan alir fase gerak, tidak dapat digunakan pada
elusi bergradien. Hanya mendeteksi solut-solut ionik. Sensitifitas sangat
bagus, selektif tetapi timbul masalah dengan adanya kontaminasi elektroda.
|
JENIS HPLC
Pemisahan dengan HPLC dapat dilakukan dengan fase normal (jika fase diamnya lebih polar dibanding dengan fase geraknya) atau fase terbalik (jika fase diamnya kurang non polar dibanding dengan fase geraknya). Berdasarkan pada kedua pemisahan ini, sering kali HPLC dikelompokkan menjadi HPLC fase normal dan HPLC fase terbalik. Selain klasifikasi di atas, HPLC juga dapat dikelompokkan berdasarkan pada sifat fase diam dan atau berdasarkan pada mekanisme sorpsi solut, dengan jenis-jenis HPLC sebagai berikut:
Pemisahan dengan HPLC dapat dilakukan dengan fase normal (jika fase diamnya lebih polar dibanding dengan fase geraknya) atau fase terbalik (jika fase diamnya kurang non polar dibanding dengan fase geraknya). Berdasarkan pada kedua pemisahan ini, sering kali HPLC dikelompokkan menjadi HPLC fase normal dan HPLC fase terbalik. Selain klasifikasi di atas, HPLC juga dapat dikelompokkan berdasarkan pada sifat fase diam dan atau berdasarkan pada mekanisme sorpsi solut, dengan jenis-jenis HPLC sebagai berikut:
1. Kromatografi Adsrobsi
Prinsip kromatografi adsorpsi telah diketahui sebagaimana dalam
kromatografi kolom dan kromatografi lapis tipis. Pemisahan kromatografi
adsorbsi biasanya menggunakan fase normal dengan menggunakan fase diam silika
gel dan alumina, meskipun demikian sekitar 90% kromatografi ini memakai silika
sebagai fase diamnya. Pada silika dan alumina terdapat gugus hidroksi yang akan
berinteraksi dengan solut. Gugus silanol pada silika mempunyai reaktifitas yang
berbeda, karenanya solut dapat terikat secara kuat sehingga dapat menyebabkan
puncak yang berekor.
2. Kromatografi Fase Terikat
Kebanyakan fase diam kromatografi ini adalah silika yang
dimodifikasi secara kimiawi atau fase terikat. Sejauh ini yang digunakan untuk
memodifikasi silika adalah hidrokarbon-hidrokarbon non-polar seperti dengan
oktadesilsilana, oktasilana, atau dengan fenil. Fase diam yang paling populer
digunakan adalah oktadesilsilan (ODS atau C18) dan kebanyakan pemisahannya
adalah fase terbalik. Sebagai fase gerak adalah campuran metanol atau
asetonitril dengan air atau dengan larutan bufer. Untuk solut yang bersifat
asam lemah atau basa lemah, peranan pH sangat krusial karena kalau pH fase
gerak tidak diatur maka solut akan mengalami ionisasi atau protonasi.
Terbentuknya spesies yang terionisasi ini menyebabkan ikatannya dengan fase
diam menjadi lebih lemah dibanding jika solut dalam bentuk spesies yang tidak
terionisasi karenanya spesies yang mengalami ionisasi akan terelusi lebih
cepat.3)
3. Kromatografi Penukar Ion
KCKT penukar ion menggunakan fase diam yang dapat menukar kation
atau anion dengan suatu fase gerak. Ada banyak penukar ion yang beredar di pasaran,
meskipun demikian yang paling luas penggunaannya adalah polistiren resin.
Kebanyakan pemisahan kromatografi ion dilakukan dengan menggunakan media air
karena sifat ionisasinya. Dalam beberapa hal digunakan pelarut campuran
misalnya air-alkohol dan juga pelarut organik. Kromatografi penukar ion dengan
fase gerak air, retensi puncak dipengaruhi oleh kadar garam total atau kekuatan
ionik serta oleh pH fase gerak. Kenaikan kadar garam dalam fase gerak
menurunkan retensi solut. Hal ini disebabkan oleh penurunan kemampuan ion
sampel bersaing dengan ion fase gerak untuk gugus penukar ion pada resin.
4. Kromatografi Pasangan Ion
Kromatografi pasangan ion juga dapat digunakan untuk pemisahan
sampel-sampel ionik dan mengatasi masalah-masalah yang melekat pada metode
penukaran ion. Sampel ionik ditutup dengan ion yang mempunyai muatan yang
berlawanan.2)
Kromatografi ini disebut juga dengan kromatografi permiasi gel dan
dapat digunakan untuk memisahkan atau menganalisis senyawa dengan berat molekul
> 2000 dalton. Fase
diam yang digunakan dapat berupa silika atau polimer yang bersifat porus
sehingga solut dapat melewati porus (lewat diantara partikel), atau berdifusi
lewat fase diam. Molekul solut yang mempunyai BM yang jauh lebih besar, akan
terelusi terlebih dahulu, kemudian molekul-molekul yang ukuran medium, dan
terakhir adalah molekul yang jauh lebih kecil. Hal ini disebabkan solut dengan
BM yang besar tidak melewati porus, akan tetapi lewat diantara partikel fase
diam. Dengan demikian, dalam pemisahan dengan eksklusi ukuran ini tidak terjadi
interaksi kimia antara solut dan fase diam seperti tipe kromatografi yang lain.
6. Kromatografi Afinitas
Dalam kasus ini, pemisahan terjadi karena interaksi-interaksi
biokimiawi yang sangat spesifik. Fase diam mengandung gugus-gugus molekul yang
hanya dapat menyerap sampel jika ada kondisi-kondisi yang terkait dengan muatan
dan sterik tertentu pada sampel yang sesuai (sebagaimana dalam interaksi antara
antigen dan antibodi). Kromatografi jenis ini dapat digunakan untuk mengisolasi
protein (enzim) dari campuran yang sangat kompleks.2)
DERIVATISASI PADA HPLC
Derivatisasi melibatkan suatu reaksi kimia antara suatu analit dengan suatu reagen untuk mengubah sifat fisika-kimia suatu analit. Tujuan utama penggunaan derivatisasi pada HPLC adalah untuk:
- Meningkatkan deteksi
- Merubah struktur molekul atau polaritas analit sehingga akan menghasilkan puncak kromatografi yang lebih baik
- Merubah matriks sehingga diperoleh pemisahan yang lebih baik
- Menstabilkan analit yang sensitif.5)
Detektor yang paling banyak digunakan dalam HPLC adalah
detektor UV-Vis sehingga banyak metode yang dikembangkan untuk memasang atau
menambahkan gugus kromofor yang akan menyerap cahaya pada panjang gelombang
tertentu. Di samping itu, juga dikembangkan suatu metode untuk menghasilkan
fluorofor (senyawa yang mamapu berfluoresensi) sehingga dapat dideteksi dengan
fluorometri.7) Suatu reaksi derivatisasi harus mempunyai syarat-syarat sebagai
berikut, yakni: produk yang dihasilkan harus mampu menyerap baik sinar
ultraviolet atau sinar tampak atau dapat membentuk senyawa berfluoresen
sehingga dapat dideteksi dengan spektrofluorometri; proses derivatisasi harus
cepat dan menghasilkan produk yang sebesar mungkin (100 %); produk hasil
derivatisasi harus stabil selama proses derivatisasi dan deteksi; serta sisa
pereaksi untuk derivatisasi harus tidakmenganggu pemisahan kromatografi.7)
Berbagai macam bahan penderivat telah tersedia antara lain :
Gugus fungsional
|
Reagen untuk dapat dideteksi dengan UV-Vis
|
Reagen untuk dapat dideteksi dengan Fluoresen
|
Asam-asam kaboksilat; asam-asam lemak;asam-asam fosfat
|
p-nitrobenzil-N,N’-diisopropilisourea (PNBDI);
3,5-dinitrobenzil-N,N’-diisopropilisourea (DNBDI); p-bromofenasil bromida (PBPB)
|
4-bromometil-7-asetoksikumarin;
4-bromometil-7-metoksikumarin;
|
Alkohol
|
3,5-dinitrobenzil klorida
(DNBC); 4-dimetilaminiazobenzen-4-sulfinil (Dabsyl-Cl); 1-naftilisosianat
(NIC-1).
|
|
Aldehid; keton
|
p-nitrobenziloksiamin hidroklorida (PNBA);
3,5-dinitrobenziloksiamin hidroklorida (DNBA);
|
Dansil hidrazin
|
Amin primer
|
Fluoresamin
o-ftalaldehid (OPA)
|
|
Amin primer (1o)
dan sekunder (2o)
|
3,5-dinitrobenzil klorida
(DNBC); N-suksinimidil-p-nitrofenilasetat (SNPA); N-suksinimidil-3,5-dinitrofenilasetat (SDNPA);
4-dimetilaminiazobenzen-4-sulfinil (Dabsyl-Cl); 1-naftilisosianat (NIC-1).
|
7-kloro-4-nitrobenzo-2-oksa-1,3-diazol
(NBD-Cl); 7-fluoro-4-nitrobenzo-2-oksa-1,3-diazol (NBD-F); Dansil klorida
|
Asam-asam amino (peptida)
|
4-dimetilaminiazobenzen-4-sulfinil
(Dabsil-Cl)
|
Fluoresamin
o-ftalaldehid (OPA)
7-kloro-4-nitrobenzo-2-oksa-1,3-diazol
(NBD-Cl); 7-fluoro-4-nitrobenzo-2-oksa-1,3-diazol (NBD-F);
|
Derivatisasi
ini dapat dilakukan sebelum analit memasuki kolom (pre-column
derivatization) atau setelah analit keluar dari kolom (post-column
derivatization).
Referensi:
- Settle, F (Editor), 1997, Handbook of Instrumental Techniques for Analytical Chemistry, Prentice Hall PTR, New Jersey, USA.
- Meyer, F.R., 2004, Practical High-Performance Liquid Chromatography, 4th Ed., John Wiley & Sons, New York.
- Kealey, D and Haines, P.J., 2002, Instant Notes: Analytical Chemistry, BIOS Scientific Publishers Limited, New York.
- Kenkel, J., 2002, Analytical Chemistry for Technicians, 3th. Edition., CRC Press, U.S.A.
- Snyder, L. R., Kirkland, S.J., and Glajch, J.L., 1997, Practical HPLC Method Development, John Wiley & Son, New York.
- Munson, J.W., 1981, Phrarmaceutical Analysis: Modern Methods, Part A and B, diterjemahkan oleh Harjana dan Soemadi, Airlangga University Press, Surabaya.
- Cserhati, T. And Forgacs, E., 1999, Chromatography in Food science and Technology, Technomic Publishing, Lancaster, Basel.